Обоснование лечения длительных симптомов C0 19 – взгляд кардиолога
 budetlyanin108 — 22.09.2022
budetlyanin108 — 22.09.2022
Интересный обзор, но несколько странные решения на основе комбинированного лечения с использованием статинов плюс антагонист рецептора ангиотензина II типа 1 на основе диеты с пониженным содержанием гистамина. А почему не применить ингибиторы гистаминовых рецепторов Н1 и Н2 то, что мы давно успешно применяем т.к. активация ТК(тучных клеток) и индуцированное высвобождение гистамина связано с клиническими симптомами, что признают и авторы статьи.
***
...необходимо обсудить несколько гипотез, касающихся лежащей в основе патофизиологии:
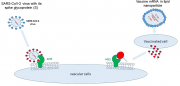
Спайк-гипотеза . Всплеск S1-антигена был обнаружен уже через 1 день после вакцинации в плазме 11 из 13 медицинских работников ( 11 ). Спайковый белок может вызывать эндотелиальную дисфункцию и нарушение гематоэнцефалического барьера ( 12 ). Кроме того, связывание белка вакцины с ангиотензинпревращающим ферментом 2 (ACE2) может способствовать альтернативному пути, вызывая дисбаланс ренин-ангиотензиновой системы (РАС) и воспаление ( 1 ). Таким образом, связывание/слияние спайкового белка с рецептором ACE2 может быть начальным шагом, ведущим к длительным симптомам Covid после инфекции или вакцинации (две стороны одного зла, рис. 1 ).
Фигура 1

Рисунок 1 . Две стороны одного зла. SARS-CoV-2 связывается через свой шиповидный белок с рецептором ангиотензинпревращающего фермента (АПФ)2, расположенным на множестве типов клеток, то есть на эндотелиальных клетках сосудов, иммунных клетках и клетках легочного эпителия. Вакцины с мРНК кодируют спайковый белок SARS-CoV-2, который синтезируется и высвобождается трансфицированными клетками и связывается с клетками, несущими рецептор ACE2.
Гипотеза антиидиотипических антител . Из-за молекулярной мимикрии обсуждалось участие антиидиотипических антител ( 13 ). В связи с этим могут образовываться антитела против индуцированных S-белком антител, которые потенциально могут связываться с исходным антигеном, который также является рецептором ACE2 ( 13 ). Это последнее может происходить неконтролируемо после инфекции SARS-CoV-2, а также у пациентов после VAC ( 13 ), тем самым нарушая баланс РАС и блокируя противовоспалительные пути.
Гипотеза комплекса антител . В качестве альтернативы Junqueira et al. ( 14 ) показали, что рецепторы Fcγ на (предварительно стимулированных ЛПС) моноцитах крови были способны распознавать комплекс SARS-CoV-2-антитело, что приводило к активированию инфламмасомы ( 14 ). В связи с этим Okuya et al. обнаружили антитела, усиливающие антитела, в 63% образцов от пациентов с острым или выздоровевшим COVID-19, и это было опосредовано Fcγ-рецептором и комплементом (C1q), что может объяснить повышенную инфекционность у некоторых пациентов ( 15 ).
Гипотеза аутоантител . Другой механизм может быть связан с аутоантителами (ААТ), которые были обнаружены при остром COVID-19 ( 16 ), а также при PASC ( 17 ). Связывание AAB с рецептором ACE2 потенциально может привести к интернализации ACE2, отщеплению ACE2 и впоследствии к дисбалансу в RAS. Папола и др. обнаружили антитела к рецептору ангиотензина II типа 1 (AT1Rab) во время инфекции SARS-CoV-2, и у пациентов с более тяжелым заболеванием было меньше AT1Rab, чем у пациентов с умеренным заболеванием, что позволяет предположить защитную роль AT1Rab при острой инфекции ( 18 ).). У пациентов с PASC были описаны функциональные ААТ с активирующей или нейтрализующей активностью в отношении рецепторов, связанных с G-белком, таких как адренорецепторы, AT1R, мускариновые М2- и эндотелиновые рецепторы ( 17 ). Паттерн ААБ может различаться индивидуально, и еще предстоит выяснить, являются ли они эпифеноменом. Кроме того, каково влияние ААБ на патофизиологию и впоследствии на клинические симптомы при PASC и пост-VAC?
Вакцино-адъювантная гипотеза . Реакции против адъюванта обсуждались ранее ( 19 ). Тем не менее, это вряд ли объясняет совпадение клинических симптомов, наблюдаемых при PASC и пост-VAC, только при воздействии вакцины-адъюванта.
Наконец, у пациентов с PASC могут проявляться различные симптомы, включая усталость, одышку, нарушение сна и трудности с концентрацией внимания ( 20 ). Эти симптомы также были зарегистрированы у пациентов после VAC. Как описано выше, убедительная гипотеза относительно лежащих в основе механизмов включает дисбаланс внутри РАС и, как следствие, нарушение иммунной реакции. Таким образом, заманчиво предположить, что, по крайней мере частично, идентичные лежащие в основе патофизиологические механизмы вызывают ПВС. В совокупности мы понимаем, что PASC и PVS имеют одинаковые иммуновоспалительные пути, и поэтому пост-VAC может служить моделью для анализа патофизиологии длительного Covid.
Роль RAS-брадикининовой оси
Ренин-ангиотензиновая система (РАС) проявляет свои биологические эффекты посредством двух сигнальных путей, суммированных на рис. 2 . Канонический ангиотензин-I-превращающий фермент1 (ACE1), ангиотензин II (Ang II), ось рецепторов ангиотензина II типа 1 (AT1R) (ACE1/AngII/AT1R), вызывающие воспаление, фиброзное ремоделирование и вазоконстрикцию. Путь противодействия через ангиотензин-I-превращающий фермент 2 (ACE2), трансформирующий ангиотензин (1-7) [Ang (1-7)], который связывается с Mas-рецептором [путь ACE2/Ang-(1-7)/MAS] и способствует антифибротическим, противовоспалительным путям и расширению сосудов ( 21 ). Дисбаланс этих двух систем был связан с развитием таких заболеваний, как повреждение легких, гипертония и сердечная недостаточность ( 22 , 23 ).
Фигура 2

Рисунок 2 . Модель двух конкурирующих осей ренин-ангиотензиновой системы. Вкратце, рецептор ангиотензина II/ангиотензина II типа 1 (AngII/AT1R) и рецептор Ang (1-7)/MAS; уравновешивающая брадикининовая система с деградацией из-за ангиотензинпревращающего фермента (ACE) и [des-Arg9]-брадикинина (DABK) ангиотензинпревращающим ферментом 2 (ACE2). Инактивация ACE2 из-за инфекции или вакцины нарушила бы пути деградации противовоспалительных Ang (1-7)/MAS и DABK, что привело бы к дисбалансу RAS и активации рецептора брадикинина-1 (B1R).
При связывании шиповидного белка с ACE2 уровень связанного с мембраной ACE2 уменьшается либо из-за интернализации, либо за счет отщепления комплекса ACE2-шипообразный белок с помощью ADAM17. Этот механизм приводит к подавлению противовоспалительного пути ACE2/ANG-(1-7)/Mas-AT2R ( 21 ). Таким образом, связывание спайкового белка с ACE2 приводит к дисбалансу в системе RAS, сдвигая ее в сторону провоспалительной оси ACE/ANGII/AT1R и последующему высвобождению цитокинов, таких как IL-6.
Система, связанная с RAS, представляет собой калликреин-кининовую систему (KKS), поскольку ACE и ACE2 являются регуляторами путей деградации в этой системе. KKS активируется при воспалении и вызывает увеличение брадикинина за счет расщепления кининогенов калликреином ( 24 ). Брадикинин может связываться с рецептором брадикинина-2 (B2R), что приводит к расширению сосудов и снижению артериального давления, таким образом, выступая в качестве естественной системы, уравновешивающей РАС. Кроме того, брадикинин может быть преобразован в дез-Arg-BK (DABK), который связывает и активирует брадикинин-1-рецептор (B1R). В то время как B2R конститутивно экспрессируется, B1R преимущественно индуцируется воспалением, но конститутивная экспрессия также была обнаружена в центральной нервной системе ( 25 ).). Как видно из бронхиально-альвеолярного лаважа (БАЛ) пациентов с COVID-19, B1R активируется и становится высоко экспрессированным ( 26 ). DABK является лигандом B1R, и его связывание приводит к стимуляции хемокинов (CXCL), iNOS и других воспалительных молекул ( 27 ). DABK может расщепляться с помощью ACE2, что приводит к меньшей активации воспалительного пути B1R.
В связи с этим, Parekh сообщил, что активация B1R индуцирует активацию дезинтегрина и металлопротеазы (ADAM) 17 в нейронах ( 28 ). Поскольку ADAM17 опосредует отщепление ACE2, это приведет к меньшей инактивации DABK, что затем может еще больше стимулировать B1R. В этом случае заманчиво предположить, что воспаление индуцирует порочный круг через путь B1R ( рис. 3 ). Другим путем, индуцирующим ADAM17, является стимуляция AT1R ( 29 ). Повышающая регуляция ADAM17 через AT1R может вызывать выброс ACE2, что затем приводит к усиленной стимуляции B1R и, таким образом, к сохранению воспалительного ответа, вызванного B1R ( 29 ). Недавнее исследование Pedrosa et al. показал в пробирке, что шиповидный белок увеличивает ADAM17 и уменьшает связанный с мембраной ACE2 ( 30 ). Таким образом, ADAM17 может быть не только ключевым игроком в регуляции путей RAS, но также играет критическую роль в патофизиологии COVID-19 и, возможно, в PVS, как показано на рисунке 3 .
Рисунок 3

Рисунок 3 . Связывание шиповидного белка SARS-CoV-2 с рецептором ангиотензинпревращающего фермента 2 (ACE2) приводит к усилению/активации рецептора ангиотензина II типа 1 (AT1) и рецептора брадикинина B1 (B1), что дополнительно индуцирует дезинтегрин и активация металлопротеазы (ADAM)17. ADAM17 является шеддазой для ACE2, и увеличение ADAM17 приводит к большей деградации ACE2. Меньшее количество ACE2 увеличит B1R (поскольку деградация [des-Arg9]-брадикинина (DABK) под действием ACE2 уменьшится, и больше DABK будет доступно для связывания с B1R).
Как указано выше, выделение ACE2 или слияние белкового комплекса ACE2 с шипом приводит к усиленной стимуляции B1R и увековечивает воспалительную реакцию, вызванную B1R ( рис. 3 ) ( 29 ). Активация B1R связана с различными симптомами и заболеваниями, связанными с сердечно-сосудистыми, неврологическими, дерматологическими, желудочно-кишечными и аутоиммунными заболеваниями ( 14 ). Сигнальный каскад B1R участвует в регуляции ноцицепции ( 31 ). Интересно, что не только ноцицепция, но также дефицит памяти и сердечно-сосудистые нарушения восстанавливались у амилоидных мышей в модели болезни Альцгеймера при блокировании B1R ( 32 ).). Лежащая в основе патофизиология включает увеличение гематоэнцефалического барьера, которое было связано с тканевой калликреиновой системой и дисбалансом равновесия между B1R и B2R (обобщенно на рисунке 2 ) ( 33 ). Активация B1R приводит к увеличению проницаемости сосудов, усилению iNOS и длительной выработке NO ( 34 ). Широкое проявление этого механизма может быть одним из важных путей, лежащих в основе клинического разнообразия симптомов и пораженных органов. Желудочно-кишечный тракт становится одним из пораженных органов, поскольку фекальная РНК SARS-CoV-2 была обнаружена у 4% пациентов через 7 месяцев после COVID-19 и была связана с желудочно-кишечными симптомами ( 35 ). Поскольку эпителиальные клетки кишечника экспрессируют ACE2 и ADAM17 (36 ), восстановление баланса RAS в кишечнике также может быть одним из важных мест. Таким образом, динамический дисбаланс в РАС и впоследствии нарушение равновесия B1R-B2R могут объяснить симфонию симптомов, наблюдаемых у пациентов с длительным течением Covid, и могут представлять собой цель для будущей лекарственной терапии.
Роль металлопротеазы ADAM17 и ее регулятора TIMP3
Другой ферментативный дисбаланс (интегрированный в сигнальный каскад RAS) был изучен у пациентов с COVID-19 и представляет собой баланс между металлопротеиназой ADAM17 и ее эндогенным ингибитором тканевым ингибитором металлопротеиназы 3 (TIMP3). Оба фермента имеют решающее значение для поддержания физиологических процессов восстановления клеток сосудов, неврологических расстройств и роста рака ( 37 ). Сообщалось о повышении уровня ADAM17 в клетках альвеолярного эпителия после заражения SARS-CoV-2 ( 36 ).). а также тенденция к снижению его ингибитора TIMP3. Таким образом, весьма вероятно, что инфекция или хроническое воспаление, о которых сообщалось при длительном Covid, приводят к стойкому дисбалансу в системе ADAM17/TIMP3. Более того, стоит предположить, что нормализация баланса RAS может впоследствии также способствовать нормализации баланса ADAM17/TIMP3. В целом контроль воспалительных процессов и процессов ремоделирования после травмы или инфекции является важной задачей для восстановления физиологии.
Механизмы регуляции центральной нервной РАС
Особый интерес представляет взаимодействие РАС в центральной нервной системе (ЦНС). AT1R расположены в головном мозге (особенно в скорлупе), и ANG II может повышать активность возбуждающих нейронов, особенно в паравентрикулярном ядре (PVN) и скорлупе, что приводит к хронической повышенной симпатической гиперактивности ( 38 ). ACE2 экспрессируется в PVN и играет роль в поддержании ингибирующего воздействия на ингибирующие ГАМК-рецепторы. Таким образом, центральная РАС участвует в нейрогенной гипертензии. Доказательства были предоставлены Mukerjee et al. ( 39), что ACE2 противостоит вегетативной дисфункции, поддерживая ингибирующие входы в пресимпатические нейроны PVN. При нокдауне ADAM17 индуцированное Ang-II повышение артериального давления притуплялось, а нейронная активация пресимпатических нейронов PVN снижалась. У крыс введение IL-1β вызывало повышение артериального давления и частоты сердечных сокращений ( 40 ). Кроме того, выявлено повышение активности центральной РАС в подфорникальном органе (ПФО) и ПВЯ. Эта экспрессия может быть ослаблена местной предварительной обработкой антагонистом AT1R лозартаном, ингибитором АПФ или ингибитором ЦОГ2. Таким образом, влияние центральной РАС на вегетативную функцию, вероятно, влияет на клинические симптомы PASC и PVS, наблюдаемые при синдроме постуральной ортостатической тахикардии (POTS) ( 41 ).). Женщины чаще страдают PASC и PVS. Связано ли это с различиями в центральной регуляции RAS ( 42 ) в центральной регуляции RAS или гормонами, еще предстоит выяснить.
Бали и др. ( 43 ) резюмирует участие РАС в боли, тревоге, а также способности к обучению и памяти. Эти симптомы регулярно появляются у пациентов с PASC и PVS. Более того, есть данные о двойной роли ANGII в ноцицепции как с усилением, так и с уменьшением восприятия боли в различных условиях и концентрациях, что делает понимание RAS еще более сложным ( 43 ). Тем не менее, эти наблюдения подчеркивают важность сбалансированной системы ренин-ангиотензин и кинин для восстановления пациентов с PASC и PVS.
Влияние дисбаланса РАС на каскады коагуляции
После заражения COVID -19 и вакцинации против SARS-CoV-2 сообщается о повышенном риске тромботических явлений, таких как тромбоэмболия легочной артерии, инфаркт миокарда и инсульт ( 41 , 44–46 ) . Цитокиновый шторм и гипоксия, приводящие к эндотелиальному повреждению, активации тромбоцитов, а также активации коагуляционного каскада, обсуждаются как основные механизмы, ведущие к нарушениям свертывания крови ( 47-49 ) . Микросгустки амилоидного фибрина обнаруживаются при острой инфекции длительно-Covid и PVS, что позволяет предположить микрососудистые осложнения как часть болезненного процесса ( 50 ). Несмотря на то, что есть доказательства благоприятного исхода при ранней антикоагулянтной терапии ( 49) данные относительно продолжительной антикоагулянтной терапии после выписки более противоречивы, поэтому следует следовать обновленным рекомендациям ( 51 ). Поскольку калликреин-кининовая система может активировать систему свертывания через фактор XII ( 52 ), терапевтические вмешательства, восстанавливающие баланс РАС и тесно связанной с ней калликреин-кининовой системы, потенциально могут также снизить гипервоспалительный и прокоагулянтный статус у пациентов с длительным течением Covid и ПВС. Следовательно, нацеливание на RAS при длительном Covid и PVS может быть полезным, поскольку блокирование AT1R восстанавливает баланс RAS из-за (1) снижения ADAM17, (2) увеличения ACE2 с последующим и (3) подавления B1R.
В отличие от канонических сердечно-сосудистых заболеваний, мы выступаем за назначение антагонистов AT1R (AT1RB) у пациентов с длительным течением Covid/PVS, поскольку мы десятилетиями знаем, что ингибиторы АПФ нарушают зависимую от АПФ деградацию брадикинина. AT1RB широко изучались in vitro и на животных моделях и широко используются в клинической практике в течение десятилетий с хорошей клинической переносимостью ( 53 ). Они имеют превосходный профиль безопасности, но различаются периодом полураспада, аффинностью связывания и липофильными структурами. Более того, как сообщала 20 лет назад наша группа ( 53), AT1RB можно скорректировать с помощью вычислительного дизайна для более высокой аффинности связывания с другими компонентами ренин-ангиотензиновой системы с аналогичными последовательностями связывания белка, например, ACE2. В связи с этим Риджуэй и его коллеги недавно показали также с помощью компьютерного моделирования, что AT1RB может быть модифицирован в сторону более высокой аффинности связывания с рецептором ACE2 (таким образом, конкурируя/удаляя с шиповидным белком SARS-CoV-2) ( 54 ).
Кандесартан и телмисартан использовались в пилотных исследованиях ( 53 ). В частности, телмисартан имеет длительный период полувыведения, высокоаффинное связывание с AT1R, а также способность модулировать PPARγ, вызывая тем самым противовоспалительный эффект. Лечение телмисартаном у пациентов с острым COVID-19 привело к более благоприятному исходу ( 55 ). При индуцированной бета-амилоидным олигомером активации микроглии телмисартан ингибировал индуцированный воспалительный ответ и увеличивал противовоспалительную экспрессию IL-10, пути, опосредованные PPARγ ( 56 ). Тем не менее, вопрос о том, могут ли различия в AT1RB повлиять на лечение длительного COVID и ПВС, следует оценивать в более крупных клинических исследованиях.
Метаболизм липидов и элиминация шиповидных белков
Известно, что фракции холестерина, особенно из липопротеинов низкой и высокой плотности, вызывают множественные биологические эффекты помимо сердечно-сосудистых заболеваний ( 57 , 58 ). Медиаторы воспаления, как известно, модифицируют фракции холестерина ЛПНП/ЛПОНП или ЛПВП либо за счет композиционных изменений, посттрансляционных модификаций белков, либо за счет изменений липидов и других грузовых молекул, таких как аполипопротеины ( 59 ). Недавние доказательства показали, что богатые холестерином липидные рафты служат платформой для проникновения SARS-CoV-2, в которой рецепторы или ферменты, такие как ACE2 и другие, например, толл-подобные рецепторы (TLR), трансмембранные сериновые протеазы (TMPRSS) рекрутируются для их взаимодействия. с вирусным шиповидным белком ( 60 , 61). Лечение провоспалительных липидных везикул установлено в терапии гиперхолестеринемии и снижает риск заболеваемости и смертности при сердечно-сосудистых заболеваниях на протяжении десятилетий ( 57 ). Лекарства, называемые «статины», ингибируют гидроксил-метилглутарилкоэнзим А (ГМГ-КоА) редуктазу, фермент, ограничивающий скорость синтеза холестерина. Более того, в течение последнего десятилетия статины использовались не только для снижения уровня холестерина, но и из-за их плейтропных эффектов, включая улучшение функции эндотелия, противовоспалительное действие и модуляцию иммунного ответа, тем самым восстанавливая окислительно-восстановительный баланс сосудов при сердечно-сосудистых и других заболеваниях ( 57 , 62 ). Недавние отчеты пациентов с тяжелым течением COVID-19 показали улучшение результатов терапии статинами.63 , 64 ). В мышиной модели симвастатин подавлял воспаление, вызванное SARS-CoV-2, индуцированной легочной инфекцией, и уменьшал медиаторы воспаления, такие как IL-6, CCL5/Rantes и TNFα, тогда как экспрессия ACE2 повышалась ( 65 ). Кроме того, симвастатин притуплял индуцированную брадикинином проницаемость в модели посткапиллярных венул in vitro ( 66 ). Это представляет особый интерес, поскольку воспаление через путь B1R, вероятно, будет одним из основных стимулов после инфекции SARS-CoV-2 или вызванного вакциной дисбаланса оси RAS-брадикинин.
Сообщалось об эндотелиальной дисфункции у пациентов с PASC ( 67 ). Если вакцины индуцируют иммуноглобулиноподобные антиидиотипические антитела или другие молекулы, которые связываются с ACE2 и вызывают дисбаланс RAS, это также может привести к дисфункции эндотелия. Поскольку терапия статинами может улучшить эндотелиальную дисфункцию, эта терапия может улучшить симптомы у пациентов с PASC и PVS. Более того, ранее широко сообщалось о противовоспалительных и иммуномодулирующих эффектах статинов ( 57 , 68 ).). Они широко используются, доступны, недороги и демонстрируют хорошие профили безопасности. Для перебалансировки системы их предполагается использовать до исчезновения симптомов, то есть всего на 2–3 месяца, что еще больше снижает риск побочных эффектов. Вопрос о том, могут ли статины улучшить клинический исход при PASC и PVS за счет усиления обратного оттока холестерина или предотвращения пагубных воспалительных эффектов, вызванных провоспалительными фракциями холестерина, требует дальнейшего анализа.
Диетические эффекты, направленные на активность тучных клеток
Желудочно-кишечный тракт выполняет не только функцию питания, но также служит основным регулирующим фактором иммунного ответа и оказывает влияние на мозг через энтеро-нейронно-мозговую систему ( 69 ). Пациенты с PASC и PVS сообщают о различных симптомах, которые совпадают с симптомами, описанными при синдроме активации тучных клеток (MCAS), а именно крапивница, ринит, усталость, одышка, головокружение, затуманенность сознания, боль в животе, диарея и т. д. ( 70 ) . Исследования последних лет показали, что постинфекционный синдром раздраженного кишечника может развиться после инфекции, и клинические симптомы могут сохраняться в течение многих месяцев ( 71 ). Основные механизмы включают низкоградусное воспаление и MCAS. Последние данные свидетельствуют о том, что MCAS связан с PASC ( 72 ).). Ранее было показано, что местные кишечные реакции на пищевые антигены (например, глютен, пшеницу, сою, молоко) могут приводить к локальному отеку, активации тучных клеток и боли в животе ( 73 ), и есть доказательства того, что тучные клетки (MC ) высвобождаемый гистамин может не только активировать висцеральные афферентные ганглии и ганглии задних корешков, но и повышать их чувствительность, что свидетельствует об усилении реакции после стимуляции ( 74 ).
Недавнее исследование показало, что спайк-опосредованная интернализация ACE2 в эндотелиальные клетки усиливалась в присутствии гистамина ( 75 ). Таким образом, вполне вероятно, что активация ТК и индуцированное высвобождение гистамина связаны с клиническими симптомами, о которых сообщают пациенты с PASC и PVS.
SARS-CoV-2 может инфицировать ткани желудочно-кишечного тракта, поскольку энтероциты тонкой кишки экспрессируют рецепторы ACE2 ( 76 ). Маловероятно, что вакцинация оказывает прямое влияние на рецепторы ACE2 в просвете кишечника, но могут быть затронуты эндотелиальные клетки сосудов, что приведет к дисбалансу RAS, локальному воспалению и повышенной кишечной проницаемости. В последние годы широко изучалась важность здорового кишечника и его влияние на микробиом, иммунную систему и ось кишечник-мозг ( 69 ). Тучные клетки могут быть активированы благодаря множеству лигандов к различным рецепторам и высвобождению таких молекул, как гистамин, триптаза, химаза, серотонин, TNFα, кинины и другие ( 70 ).). Поскольку химаза может служить альтернативным путем для превращения Ang-1-12 в Ang II, это может стимулировать AT1R, особенно когда ACE2 подавляется, тем самым дополнительно усиливая дисбаланс RAS. Индуцированная аллергией или гельминтами IgE-опосредованная активация ТК может ускорить симптомы у предрасположенных пациентов. Таким образом, следует рассмотреть вопрос о подробном сборе анамнеза о ранее существовавших аллергиях, паразитарных инфекциях или аутоиммунной предрасположенности. В случае уже существующей известной пищевой непереносимости может быть полезно также избегать этих питательных веществ. Из-за клинического совпадения симптомов и потенциального совпадения патофизиологических путей, вероятно, произойдет активация СК, а высвобождение гистамина из СК может представлять собой триггер клинических симптомов при PASC и PVS. Таким образом, диета с низким содержанием гистамина, а также избегание уже известных пищевых аллергенов,77 ) для улучшения клинических симптомов пациентов. Пациенты часто борются с этими изменениями в диете. Поэтому рекомендуется обратиться к диетологу. Кроме того, мониторинг и информация на основе приложений могут помочь пациентам в принятии, соблюдении режима лечения и самообучении.
Взгляд кардиолога
Пытаясь обобщить сложную патофизиологию, возникающую в результате дисбаланса системы РАС, мы сначала подчеркнем, что длительные симптомы Covid могут возникать либо после заражения SARS-CoV-2, либо после вакцинации. Однако лежащие в основе механизмы требуют дальнейшего анализа, но последние данные подтверждают сложную иммунно-воспалительную сигнальную сеть, включающую дисбаланс в системе RAS, а также нарушение равновесия B1R-B2R ( рис. 2 ).). Поэтому маловероятно, что терапевтический подход, направленный только на один шаг в сложной системе, будет достаточным и достаточно эффективным для лечения такого сложного синдрома. Поэтому здесь мы пропагандируем многомерный подход, нацеленный на основные регулирующие пути, участвующие, а именно, на ось RAS-брадикинин, метаболизм холестерина и, наконец, микробиом кишечника ( рис. 4 ).). В частности, AT1RB уравновешивает ось RAS-брадикинин, терапия статинами улучшает функцию эндотелия и вызывает плейотропные противовоспалительные эффекты, все вместе стимулируя иммуномодулирующие пути. Эти две лекарственные терапии должны регулироваться диетой с пониженным содержанием гистамина, ограничивающей эффекты тучных клеток, уменьшающей воспаление и потенциально восстанавливающей микробиом кишечника. Изменения в образе жизни, такие как диета с пониженным содержанием гистамина, сложны для пациентов, особенно в свете ранее существовавшей или недавно развившейся пищевой непереносимости или аллергии. Таким образом, следует рассмотреть вопрос о направлении к диетологу. В настоящее время приложения и цифровая информация с веб-сайтов учреждений могут способствовать принятию пациентов, их соблюдению и самообразованию.
Рисунок 4

Рисунок 4 . Модель одновременного тройного вмешательства с блокадой рецепторов ангиотензина II типа 1, ингибированием ГМГ-КоА-редуктазы и диетическим вмешательством для преодоления порочного круга сосудистого взаимодействия между дисбалансом ренин-ангиотензиновой системы (РАС) и непрерывным образованием тучных клеток. активация при дисбактериозе микробиома, а также для восстановления сосудистой функции и уменьшения воспаления.
До сих пор биомаркеры для PASC и PVS не оценивались. Разнообразие симптомов требует тщательного и индивидуального обследования пациентов для исключения других причин или сопутствующих заболеваний, особенно микротромбов или реактивации других инфекций, о которых сообщалось при PASC и PVS ( 78 , 79 ).). Разнообразие симптомов при PASC и PVS с необходимостью обширной оценки и обследования является сложной задачей для пациентов и клиницистов и усложняет дизайн клинических испытаний. Поскольку существует острая необходимость в терапии, улучшающей клинические исходы, широко применимой и с низким риском побочных эффектов, мы предложили следующую стратегию: комбинированное лечение с использованием статинов плюс антагонист рецептора ангиотензина II типа 1 на основе диеты с пониженным содержанием гистамина. . Восстановление баланса SARS-CoV-2 или вызванных вакциной нарушений с помощью многомерного подхода может быть многообещающим способом лечения пациентов с PASC и PVS, и его следует оценить. Это не конец длинной истории с COVID, но она может расширить наш арсенал средств для защиты пациентов от пагубного воздействия шиповидных белков. Детальные генетические и молекулярные исследования,
|
|
</> |


 Bigger — современные технологии для людей с ослабленным зрением
Bigger — современные технологии для людей с ослабленным зрением  Обновления 98.7
Обновления 98.7  Красный барон
Красный барон  «До СВО я думал, что у нас и лазеры есть» – Живов засомневался в нашей
«До СВО я думал, что у нас и лазеры есть» – Живов засомневался в нашей  Очень уютный дом «Г»-образной формы
Очень уютный дом «Г»-образной формы  Девять лет как целая жизнь
Девять лет как целая жизнь  "Битва за битвой"/"One Battle After Another" [2025]
"Битва за битвой"/"One Battle After Another" [2025]  А всё- таки она вертится...
А всё- таки она вертится...  Экспансия.
Экспансия. 



