Моноклональные антитела против «законсервированного» эпитопа белка S и их
 prof_afv — 21.11.2021
prof_afv — 21.11.2021
Я закончил предыдущий пост обещанием написать о результатах клинического испытания моноклональных антител sotrovimab. Выполняю обещание.
Вообще-то, эти антитела интересны сами по себе. Достаточно сказать, что они эффективно нейтрализуют in vitro не только SARS-CoV-2, но и SARS-CoV-1 (возбудитель предшественника COVID-19 — SARS). Эпитоп, против которого они направлены, располагается вне RBD области белка S и этот участок молекулы исключительно «законсервирован» у коронавирусов. Это делает маловероятным, что этот эпитоп будет «разрушен» в ходе эволюции SARS-CoV-2, «подбрасывающей» проблемные варианты вируса. Всё это заслуживает отдельного поста. Но сегодня, как было анонсировано, я коротко остановлюсь на схеме и результатах клинического испытания sotrovimab, которые недавно были опубликованы в New England Journal of Medicine ( https://www.nejm.org/doi/full/10.1056/NEJMoa2107934 ).
Данные о том, что эти моноклональные человеческие антитела весьма перспективны как средство пассивной иммунопрофилактики/терапии COVID-19, были опубликованы в Nature ещё в мае 2020г. (https://www.nature.com/articles/s41586-020-2349-y ). Если заинтересуетесь этой статьёй, имейте в виду, что в ней данные антитела называются S309. Эти антитела были сделаны в сравнительно небольшой биотехнологической компании Vir Biotechnology. Далее за их «доведение» взялась крупная фармкомпания GlaxoSmithKline (GSK). Специалисты GSK путём генетических манипуляций модифицировали антитела S309 в той части молекулы, которая не имеет отношения к связыванию антител с эпитопом. Эта модификация повысила стабильность данных антител in vivo, что сделало их более «долгоиграющими». Именно эти антитела получили некомерческое фармакологическое название (sotrovimab) и начались их клинические испытания.
Целью испытания было определить эффективны ли эти антитела в предотвращении тяжёлого COVID-19 при однократном введении амбулаторным больным COVID-19, у которых был повышен риск развития тяжёлого COVID-19 из-за наличия сопутствующих хронических заболеваний. Группы сравнения (sotrovimab и плацебо) были рандомизированы и испытание проводилось с двойным слепым контролем. На рисунке ниже схема испытания.

Думаю, объяснять не надо. Рисунок очень информативен.
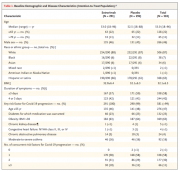
Следующее, что надо знать для того, чтобы оценить корректность испытания — это размеры и степень сбалансированности сравниваемых групп. Эта информация представлена в таблице ниже.

Как видите группы схожи по многочисленным параметрам, несбалансированность по которым может повлиять на результат сравнения.
В следующей таблице представлены данные о частотах клинически значимых исходов. Среди исходов выделяется главный (primary outcome). Что это такое должно быть чётко сформулировано ДО начала клинического испытания. В данном испытании «главным исходом» была «госпитализация длительностью более 24 часов по любой причине или смерть». Такие «составные исходы» (по-научному, композитные – composite outcome) используются для того, чтобы повысить вероятность обнаружения статистически значимых отличия. В принципе, это некоторая «натяжка», но она очень часто используется в клинических испытаниях, особенно, когда размер выборок сравнительно невелик.

Из таблицы видно, что по всем исходам показатели в группе sotrovimab лучше, но в большинстве сравнений разница небольшая и уровня статистической значимости не достигает. Но по главному исходу различия статистически значимы (p = 0,002), а снижение относительного риска – 85% (доверительный интервал 44-96%). Обратите внимания, что если смотреть на абсолютные цифры, то разница конечно есть, она не так «броско» выглядит: в группе sotrovimab было госпитализировано 1%, а в группе плацебо 7%; в группе плацебо был один летальный исход, а в группе sotrovimab ни одного. На этой стадии этический комитет остановил испытание, посчитав, что его продолжение неэтично в отношении группы плацебо.
По поводу нежелательных явлений (НЯ) – данные суммированы в следующей таблице.

Как видите, и здесь sotrovimab выглядит лучше плацебо, т.е. никакого «сигнала» опасности не зафиксировано. Помимо этого, такие результаты (а они не редки в клинических испытаниях) свидетельствуют о том, что фаза 1 (безопасность) клинических испытаний, в которой отсутствует плацебо-контроль, в некотором смысле «ущербна».
На основании приведенных выше данных, в конце мая 2021г. FDA выдал для sotrovimab временное разрешение на применение в чрезвычайных условиях – EUA (emergency use authorization). Это разрешение позволяет использование sotrovimab для:
· Лечения (амбулаторного) COVID-19 лёгкой и средней тяжести у взрослых и детей (12 лет и старше, вес не менее 40кг) при наличии положительного результата прямого теста на SARS-CoV-2, у которых есть высокий риск прогрессии до тяжёлого COVID-19, включая госпитализацию и смерть
Не разрешается использовать sotrovimab для:
· Лечения пациентов, госпитализированных с COVID-19 или нуждающихся в кислородной терапии в связи с COVID-19.
Пока это всё по данному лекарственному препарату (его торговое название – Хevudy). Помимо EUA от FDA у него есть аналогичные разрешение в EC (от EMA) и в Австралии. Но это так, кстати. Пост я написал для того, чтобы на конкретном примере показать, что предстоит пройти экспериментальному препарату моноклональных антител, который выглядит перспективным по его характеристикам in vitro и результатам доклинических испытаний. И чего от таких препаратов можно ожидать.
Нужно сказать, что big pharma активно включилась в разработку подобных препаратов. В частности, AstraZeneca пообещала, что их препарат (AZD7442) сможет действовать до 12 месяцев. Если, подтвердится, это будет прорывом для тех, кто из-за иммунодепрессии плохо отвечает на вакцинацию. Но всё это очень дорого. Для примера, правительство США закупило у Regeneron 1,4 миллиона доз REGN-COV (это самый распространённый на сегодня препарат этой группы) по цене 2100 долларов за дозу. Остаётся надеется, что со временем цена упадёт.
Проф_АФВ

 Музыкальное лото SMARTY в Москве: когда игра становится праздником
Музыкальное лото SMARTY в Москве: когда игра становится праздником  Наша первая остановка, и снова Питер
Наша первая остановка, и снова Питер  С Наступившим и наступающим!
С Наступившим и наступающим!  Фотосет в Схидаме
Фотосет в Схидаме  Марион Брюне: попытка (нео)вестерна
Марион Брюне: попытка (нео)вестерна  В Германии предложили немедленно выслать из страны всех украинских беженцев
В Германии предложили немедленно выслать из страны всех украинских беженцев  Неожиданный поворот
Неожиданный поворот  к 80-летию Победы - 1
к 80-летию Победы - 1  Неморозы
Неморозы 



