Промежуточные результаты испытаний вакцины AstraZeneka. Не было счастья, да
 prof_afv — 10.12.2020
prof_afv — 10.12.2020
Начну издалека. «Запуск» клинического испытания на десятках тысяч человек не может быть одномоментным. Рекрутирование добровольцев для таких испытаний это процесс, растянутый во времени (на месяцы) и в пространстве (множественные «опорные пункты», нередко в разных странах). За это время могут возникнуть непредвиденные обстоятельства, требующие корректив в протоколе испытаний. Окончательные результаты Фазы 3 клинических испытаний становятся известными спустя довольно продолжительное время – многие месяцы, иногда, годы. А когда испытывается вакцина против неизвестного ранее возбудителя (каковым является SARS-CoV-2), все эти сложности усиливаются многократно. А время не ждёт! Поэтому протоколы всех клинических испытаний предусматривают возможность для подведения предварительных итогов и оговаривают, как и когда это должно делаться.
Статья в Lancet это первое и пока единственное научное описания такого промежуточного анализа (https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)32661-1/fulltext). Нужно чётко понимать, что анализ этот промежуточный, а его итоги предварительны. Это касается не только вакцины, которой посвящена статья (AZD1222 или СhAdOx1 nCoV019), но и всех других коронавирусных вакцин, результаты промежуточного анализа испытаний которых, надеюсь, будут опубликованы в ближайшем будущем.
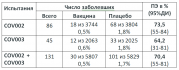
Теперь конкретно об опубликованных данных о протективной эффективности вакцины AZD1222 (в статье используется название СhAdOx1 nCoV019, но для краткости дальше я буду использовать синоним - AZD1222). В таблице 1 представлены данные по протективной эффективности (ПЭ) против клинически выраженного и вирусологически-подтверждённого (положительный тест на РНК SARS-CoV-2), как индивидуально по испытаниям в Великобритании (COV002) и Бразилии (COV003), так и объединённые данные. Учитывались только случаи заболевания, развившегося не раньше, чем через 14 дней после второй инъекции вакцины.
Таблица 1. Протективность против заболевания

В статье есть и данные по показателю заболеваемости, который позволяет провести наиболее корректные расчёты протективности (incidence rate per 1000 person-days of follow-up). Но для поста эти и многие другие детали, имеющиеся в статье, думаю, чрезмерны.
Теперь о данных, относящихся к главному «сюрпризу» этих испытаний – повышенной ПЭ против COVID-19 и против инфицирования SARS-CoV-2 в подгруппе, получившей половинную дозу вакцины в первой инъекции. Эти данные приведены в Таблицах 2 и 3.
Таблица 2. Протективность против заболевания, «малая доза»

Таблица 3. Протективность против инфекции, «малая доза»

Как видно из таблиц 2 и 3, различия в протективной эффективности против заболевания существенны, а против инфекции разительны (отрицательная величина ПЭ = повышенная чувствительность). Ошибочка с дозой может оказаться чем-то вроде «находки клада». Но как получилось, что больше тысячи испытуемых получили половинную дозу вакцины? В статье это разъяснено. Ситуация классическая – как у Райкина – «пиджак крив и кос, но один портной пришивал правый рукав, другой левый, третий пуговицы... и к ним индивидуально претензий нет»... В случае этого испытания повезло, возможно, очень сильно повезло. Но урок извлечь нужно. А произошло всё так. Большое клиническое испытание это не «натуральное хозяйство» - многие необходимые материалы и услуги закупаются у коммерческих организаций. В частности, вакцинный препарат, разработанный в лабораториях Оксфорда, для испытаний нарабатывают биотехнологические компании. Прежде чем, начать COV002 (фаза 2-3) было проведено испытание COV001 (фаза 1-2). Вакцину для COV001 поставила одна фирма, а для начала COV002 другая. Количество вируса в вакцине для COV001 определяли с помощью спектрофотометрии (по поглощению ультрафиолета с длиной волны 260нм – это близко к максимуму поглощения нуклеиновыми кислотами). Это простой и удобный метод, но на его результаты могут повлиять примеси, присутствующие в препарате «очищенного» вируса (очистка никогда не бывает 100%). Вторая компания, во-первых, использовала другую процедуру очистки вируса и, во-вторых, измерила концентрацию вируса не только спектрофотометрически, но и с помощью количественной ОТ-ПЦР (количественное определение вирусной РНК). Результаты заметно отличались – по сравнению с ПЦР, спектрофотометрическое измерение завышало концентрацию вируса в 2 раза (т.е. на самом деле вируса в препарате было в 2 раза меньше). В этой ситуации комитет, управляющий испытанием, запросил мнение британского регулятора, решающего разрешать вакцины или нет (Medicines and Healthcare products Regulatory Agency). Логично? Да. Регулятор ответил – руководствуйтесь данными спектрофотометрического замера, чтобы сохранить преемственность с COV001 (но не учёл, что процедуры очистки и следовательно примеси были разными). Так начали вводить половинную дозу. Заметили, что что-то не так по понижению частоты «побочек». К этому времени было уже проиммунизировано больше тысячи человек. Снова обратились к регулятору - что с этим делать? Те ответили – вводите полную вторую дозу, а дальше посмотрим... После этого инцидента, была проведена работа по стандартизации методов определения дозы и, как утверждается в статье, теперь этот вопрос решён.
Пост уже довольно длинный. В статье есть ещё много интересных конкретных данных (это 13 страниц убористого текста и множество онлайн дополнений). Тем, кто хочет с этим разбираться углублённо, советую обратиться к оригиналу. О «нежелательных явлениях» и некоторых общих вопросах, связанных с «шимпанзячей» вакциной AZD1222 напишу отдельно.
(с) Проф_АФВ
|
|
</> |


 Комплексный анализ Loto Club: технологические решения, функциональность и перспективы развития цифровой платформы
Комплексный анализ Loto Club: технологические решения, функциональность и перспективы развития цифровой платформы  Ежедневный дайджест марафона #осеньвкармане — 17 ноября
Ежедневный дайджест марафона #осеньвкармане — 17 ноября  О ценах на продукты в "Ашане" в Москве и в Киеве
О ценах на продукты в "Ашане" в Москве и в Киеве  Воскресные коты
Воскресные коты  Демократия в США? Никогда не слышала!
Демократия в США? Никогда не слышала!  Про соцопросы
Про соцопросы  Хорошая книга. Точнее книги. Точнее автор.
Хорошая книга. Точнее книги. Точнее автор.  Трамп и месть
Трамп и месть  Отношения и кекс.
Отношения и кекс. 



